以下是小鼠肺微血管内皮细胞的提取步骤:
1.实验动物:选用健康的小鼠,一般为清洁级或SPF级,6-8周龄,体重根据品系有所差异,通常在18 - 22g左右。提前将小鼠置于适宜的饲养环境(温度22-25℃,湿度50%-60%,12h光照/12h黑暗循环)中适应1-2天。
2.实验试剂:无菌PBS(磷酸盐缓冲液),(启达生物,货号:SD0029)
0.1%-0.2%(w/v)胶原酶Ⅱ溶液
ECGM-M内皮细胞培养基(启达生物,货号:P1001-M)
红细胞裂解液(启达生物,货号:SD0063)
细胞包被液(启达生物,货号:SD0044)
3.实验器材:
手术器械:包括眼科剪、眼科镊、手术刀等,需提前高压灭菌处理。
培养皿、离心管、移液管、滴管等:均需为无菌一次性用品。
细胞筛:孔径为70μm和40μm,用于过滤组织悬液,去除较大的组织碎片。
离心机:用于细胞的离心沉淀。
培养箱:设置温度为37℃,含5%CO₂的饱和湿度环境,为细胞提供适宜的生长条件。
提取步骤
1.小鼠处死与取材:
将小鼠用颈椎脱臼法或过量麻醉剂(如戊巴比妥钠,剂量为50-100mg/kg体重)处死,迅速将其仰卧固定于解剖板上。
用75%酒精消毒腹部皮肤,沿腹部正中线剪开皮肤和腹壁,暴露胸腔。
用眼科剪小心剪开胸腔,充分暴露心脏和肺脏。
用注射器经右心室向肺动脉内注入约5ml无菌PBS,直至肺脏变白,以冲洗掉肺内的血液。
用眼科剪小心剪下肺脏,放入盛有预冷无菌PBS的培养皿中,轻轻漂洗2-3次,去除表面的血迹和杂质。
2.组织剪碎与消化:
将漂洗后的肺脏转移至新的无菌培养皿中,用眼科剪将肺组织剪成约1mm³的小块。
将剪碎的肺组织块转移至离心管中,加入适量的胶原酶Ⅱ溶液(每克肺组织约加入5-10ml),轻轻混匀。
将离心管用封口膜密封好置于37℃水浴中消化30-60min,期间每隔5-10min轻轻振荡一次,使消化充分。
3.细胞悬液制备:
消化结束后,将离心管取出,800-1000r/min离心5 - 10min,弃去上清液。
向沉淀中加入适量的红细胞裂解液,轻轻吹打混匀,室温静置5-10min,以裂解红细胞。
再次800-1000r/min离心5min,弃去上清液。
用适量的内皮细胞培养基重悬沉淀,然后依次通过70μm和40μm的细胞筛,去除较大的组织碎片,得到单细胞悬液。
4.细胞接种与培养:
将单细胞悬液转移至离心管中,800-1000r/min离心5 min,弃去上清液。
用适量的内皮细胞培养基重悬细胞沉淀,调整细胞密度至(1 -2)×10^6cells/ml。
将细胞悬液接种于预先包被有明胶或纤连蛋白的培养瓶或培养板中,置于37℃、5% CO₂培养箱中培养。
培养12小时后,轻轻倒掉培养液,用无菌PBS轻轻漂洗2-3次,去除未贴壁的细胞,然后加入新鲜的内皮细胞培养基继续培养。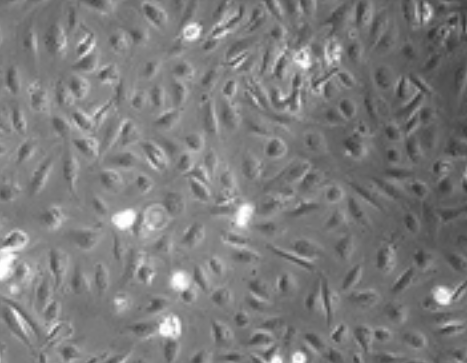
后续观察与鉴定
1.细胞观察:
在培养过程中,每天在倒置显微镜下观察细胞的生长状态和形态,记录细胞的贴壁情况、生长速度、形态变化等。正常的肺微血管内皮细胞呈铺路石样外观。
2.细胞鉴定:
培养至细胞融合度达到70%-80%时,可进行细胞鉴定。常用的鉴定方法包括免疫荧光染色检测内皮细胞特异性标志物(如CD31、vWF等)、摄取乙酰化低密度脂蛋白(Ac - LDL)等。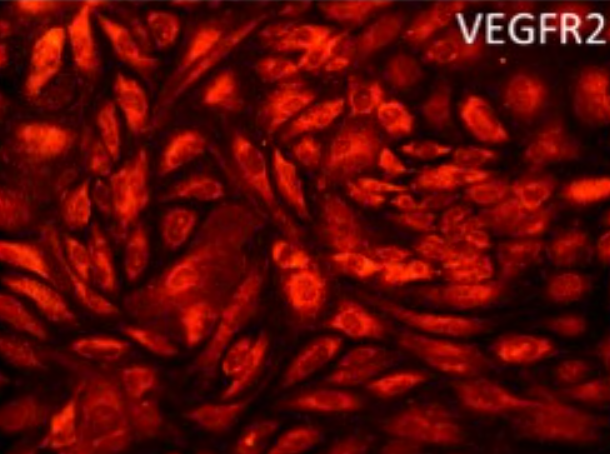
以上步骤仅为一般的小鼠肺微血管内皮细胞提取方法,实际操作中可根据具体实验要求和实验室条件进行适当调整。
推荐产品:
ECGM-M小鼠内皮培养基(货号:P1001-M)
内皮细胞培养基经10种人各部位的内皮细胞的测试和优化,经无菌,无支原体,无内毒素检测,添加肝素,内皮生长因子,胰岛素,抗氧化剂,皮质醇等组分,为了实现细胞的正常的新陈代谢过程,培养基尽量减少生长刺激的因子组分。
适用除人源外哺乳动物内皮细胞的生长。
免程序降温细胞冻存液(低血清)(货号:SD0001) 让细胞冻存更加方便:
让细胞冻存更加方便:
1.它无需程序降温,细胞冻存后直接放入-80°过夜,24小时移入液氮即可。
2.它含有2%的血清,含有抗氧化剂和细胞休眠时所细胞的蛋白质和氨基酸。
3.它只含有5%DMSO,因为DMSO一旦浓度过高会导致细胞在冻存时中毒,复苏细胞存活少,或者长时间不长。
提取步骤
